메트포르민 31품목의 제조 및 판매가 26일 부터 잠정 중지됐다.
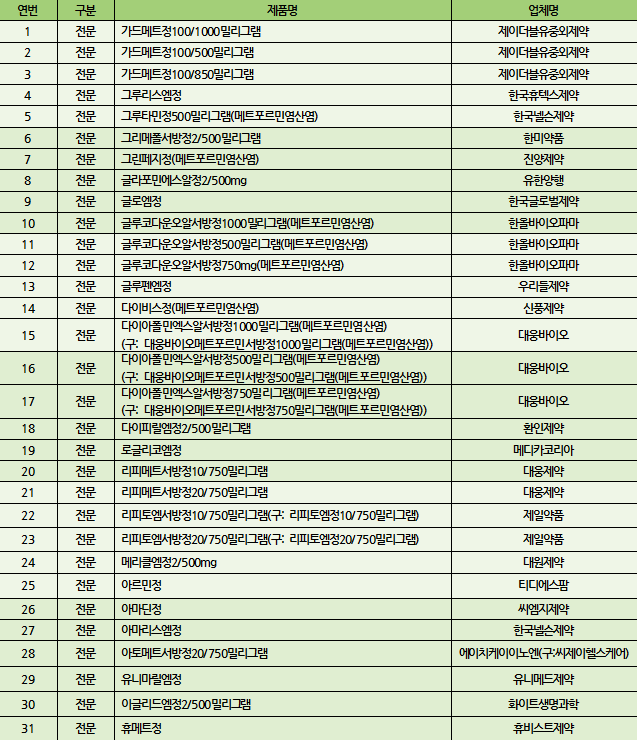
식품의약품안전처는 당뇨병치료제 메트포르민의 국내 유통 원료의약품과 완제의약품을 모두 수거․검사한 결과, 국내 제조 31품목에서 NDMA(N-니트로소디메틸아민)가 잠정 관리기준을 넘었다고 이같이 조치했다고 밝혔다[표]. 이에 따라 건강보험심사평가원 의약품안전사용정보시스템(DUR)을 통해 처방 및 조제는 물론 건강보험 급여 적용도 정지됐다.
NDMA는 세계보건기구(WHO) 국제 암연구소(IARC)가 지정한 인체 발암 추정물질(2A)이다. 식약처에 따르면 메트포르민의 NDMA 잠정관리기준은 1일 최대허용량(96나노그램)을 기준으로 1일 최대 복용량을 평생 복용하는 것을 전제로 1일 최대 1,000mg 복용시 0.096ppm, 1일 최대 2,550mg 복용시 0.038ppm으로 정했다.
식약처는 그러나 이들 품목에 대해 인체영향평가 결과 암이 추가로 발생할 가능성은 10명 중 0.21명으로 매우 낮은 만큼 환자가 임의로 복용을 중단해선 안된다고 말했다.
현재 국내 유통 중인 메트포르민 완제의약품은 228개이며, 복용 중인 환자 수는 총 26만명이다. 완제의약품의 경우 수입제품 34품목 모두 잠정관리기준 이하였다.
관련기사
