완전히 새로운 형태의 알츠하이머병(AD) 증례가 오사카시립대학에서 보고됐다(Ann Neurol 2008; 63: 377-387). 증례 환자는 59세 때 AD로 진단됐지만 PET를 이용한 아밀로이드 이미징에서 노인반이 검출되지 않고 뇌위축도 거의 나타나지 않았다.
AD의 발병 원인과 관련해 최근 재미과학자 김태완 박사가 AD의 원인은 베타아밀로이드(Aβ) 단백질의 가용성(可溶性) 올리고머(저중합체)가 시냅스를 직접 장애시키기 때문이라는 연구결과를 발표한 바 있다. 이번 증례는 이러한 가설을 사람에서 최초로 입증시킨 것으로 주목받고 있다. 오사카시립대학 뇌신경과학 모리 히로시 교수에게 들어본다.
섬유화되지않는 Aβ 결실 변이
모리 교수가 보고한 환자는 55세 일본여성으로 2001년에 이 대학병원에서 처음으로 진료를 받았다.
주소는 경도의 기억장애. 경도 인지기능장애(MCI)로 진단됐지만 처음 진찰 당시 인지기능검사(MMSE) 점수는 정상이었고 다른 신경학적 이상 소견도 없었다.
MRI 소견에서 뇌위축 현상도 없었으며 뇌속의 당대사를 보여주는 핵의학 검사인 FDG-PET에서도 비정상적인 글루코오스 대사는 검출되지 않았다.
59세에 MMSE 점수는 22/30으로 낮아져 AD로 진단됐다. 61세에는 18/30으로 더 낮아져 AD의 동반증상인 소뇌운동실조, 보행장애, 관념운동 행위상실증(특정 행동에 대한 장애) 등이 나타났다.
62세에는 인지기능장애가 더 심해져 점수도 5/30까지 낮아졌다. 그런데도 뇌속의 베타아밀로이드 단백질의 분포와 축적 상황을 보여주는 핵의학 검사인 PIB-PET에서 양성 시그널은 거의 검출되지 않았다.
조사 결과, 환자의 어머니를 포함해 외가쪽 6명 중 4명이 치매에 걸려 일찍 사망한 것으로 밝혀졌다.
교수팀이 환자와 친척의 동의하에 가족성 AD의 원인 유전자인 아밀로이드 전구체단백(APP), 프레세닐린(PSEN1, 2)의 각 유전자를 조사한 결과, APP의 17번 엑손에 변이가 발견됐다.
PSEN1, 2에는 이상한 점이 없었다. APP 17번 엑손의 변이는 693번 코돈의 결실이라는 지금까지 알려지지 않았던 사실로서, 결과적으로 베타아밀로이드 22번 글루타민산이 없어진다(E22Δ).
환자는 이 변이의 호모접합체였다. 또한 환자의 자매 3명 중 1명이 호모접합체, 2명이 헤테로접합체로서 호모접합체인 여동생은 몇 년 후 AD를 일으켰지만 헤테로접합체 2명은 완전 정상이었다.
아울러 최근 AD의 강력한 위험인자로 지적되는 아포리포단백E의 서브타입 ε4는 없었으며 환자를 포함해 전원이 ε3의 호모접합체였다.
교수팀은 이 결실 변이와 AD의 관련성을 찾기 위해 일본인 5,310명을 스크리닝했다.
이 중 2,121례가 AD, 128례가 MCI, 74례가 레비소체형 치매, 2,541례가 건강인이이었다.
호모 결실이 AD환자 1례(36세 여성)에서, 헤테로 결실이 건강한 남성(64세)과 경도 인지장애를 보인 남성(81세) 2례에서 검출됐다. 또한 일본에서는 호모결실 2례가 보고됐다고 한다. 베타아밀로이드는 APP에서 단백질분해 효소인 세크레타제에 의해 잘린다.
주로 아미노산 40개로 구성되는 베타아밀로이드 1-40과 아미노산 42개의 Aβ1-42가 있으며 후자가 더 섬유화되기 쉽고 병원성도 높다고 알려져 있다.
AβE22Δ가 시냅스 기능 방해
이번 새로운 결실 변이가 발견된 APP 693 코돈은 지금까지도 변이가 다수 보고되고 있어 AD 발병과 밀접하게 관련하는 ‘핫 스팟’으로 주목되고 있다(모리 교수).
하지만 기존 보고례는 모두 원래 글루타민산을 나타내는 코돈이 다른 아미노산의 코돈으로 바뀌는 미스 센스(DNA 암호가 바뀌어 본래와 다른 아미노산을 지정하게 되는 돌연변이 암호) 변이로서 Aβ와 Aβ1-42의 생산을 늘리거나 섬유화되기 쉬운 것으로 판명됐다.
그렇다면 이번 변이로 발생한 22번 글루타민산을 결실한 Aβ(Aβ1-40 E22Δ Aβ1-42 E22Δ)는 어떠한 표현형을 나타내는 것일까. 교수팀은 환자의 경과 관찰과 아울러 합성 펩타이드를 이용해 검토했다.
APP E693Δ에 의해 Aβ 전체의 생산량은 크게 줄어들지만 Aβ의 주요 분해 효소인 네프리라이신, 인슐린 분해효소에 좀더 강력한 저항성을 나타냈다.
또한 섬유화된 Aβ에 특이적으로 접착하는 티오플라빈 T에 형광표지하여 시간별 섬유화 정도를 측정해 보면 야생형(WT) Aβ는 급속하게 형광 강도가 추가되는 반면 AβE22Δ는 1주 이상 지나도 형광 강도가 높아지지 않았다(그림1 왼쪽).
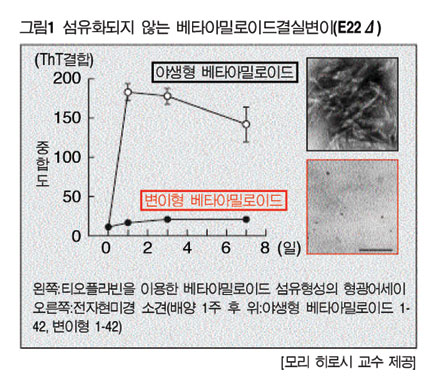
또한 각각의 배양액을 1주 후 전자현미경 소견에서 WT에서는 중합에 의한 매우 뚜렷한 섬유화가 나타났지만 E22Δ에서는 나타나지 않았다(그림1 오른쪽).
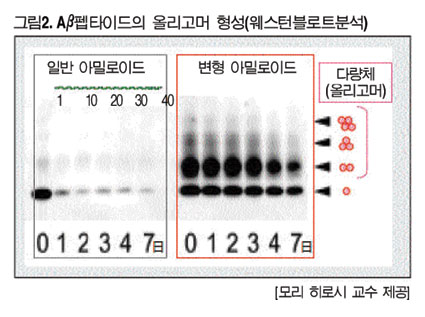
각각의 합성 펩타이드의 전기영동상에서는 WT는 일시적으로 모노머(단량체)를 형성한 이후 재빠르게 감소했지만, E22Δ에서는 모노머 외 2량체, 3량체 등 이른바 가용성 올리고머가 매우 분명하게 형성됐다.(그림2)
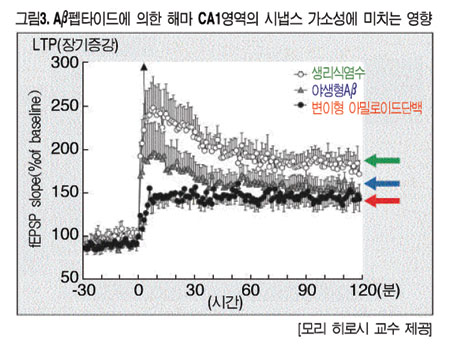
이어 WTAβ, AβE22Δ를 각각 래트의 뇌실 속에 주입하고 해마의 흥분성 시냅스 후전위(EPSP)를 측정한 결과, E22Δ에서는 매우 뚜렷하게 낮아졌으며(생리식염수 주입군과 WTAβ군에 대해 P<0.0001), 해마의 장기증강(LTP)이라는 학습효과가 거의 다 없어진 것으로 판명됐다.(그림3)
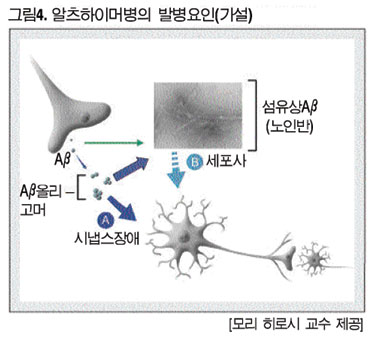
일련의 결과에 대해 교수는 “발단이 된 환자는 PIB-PET 아밀로이드 이미징이 음성이었지만 이것이 실험에서도 입증되면서 AβE22Δ펩티드는 섬유를 형성하지 않는다는 사실을 알게 됐다. 또한 중합하여 섬유화하는 야생형 Aβ펩타이드보다 훨씬 시냅스 독성이 강한 것으로 시사됐다”고 지적했다.
Aβ섬유 형성은 발병에 필수 요소?
기존에 AD는 가족성과 고발성(단독 발생)을 불문하고 병리학적으로 Aβ의 비정상적인 축적에 따른 노인반 형성이 원인으로 지적됐다.
그리고 노인반이 쌓이면서 신경원섬유가 변화하고 신경세포사를 초래하는 등 치매증상은 이 병리 캐스캐이드처럼 중증화된다고 알려져 있었다.
한편 최근들어 배양세포나 실험동물을 이용한 연구를 기초로 하여 AD에서의 시냅스 기능 장애나 인지기능 장애는 Aβ의 뇌속 축적에 의한 원섬유 형성보다는 오히려 Aβ의 2량체, 3량체 등의 가용성 올리고머 때문이라는 가설이 제창됐다.
최근 사이언스에 관련 논문을 발표한 하버드대학 데니스 셀코(Dennis J. Selkoe)씨는 이러한 실험 결과들을 근거로 가용성 올리고머는 Aβ의 생성 후 신속하게 형성되어 섬유화된 Aβ보다 먼저 해마 LTP 억제에 특이적으로 관계하고 있다고 말했다(Science 2002; 298: 789-791).
그러나 지금까지의 실험적 에비던스를 사람에서 검증한 사례는 없었던 만큼 이번 연구가 갖는 의미는 매우 크다.
모리 교수팀은 현단계에서는 발단이 된 증례를 ‘AD서브타입’이라고 부르면서도 다음과 같이 이야기하고 있다.
“AD 발병에는 Aβ올리고머에 의한 직접적인 시냅스 장애와 기존에 언급돼 왔던 Aβ의 섬유화에 의한 노인반 형성 2가지 경로가 있는게 아닐까 생각된다. 전자를 A경로, 후자를 B경로라고 하면 AB양쪽 경로가 있어도 좋다. 그러나 A경로가 있는 상태에서 B경로는 동반되는 적어도 필수는 아니라고 생각된다(그림4).”