1상 임상서 안전성 확인
【뉴욕】 피츠버그대학 크리스토퍼 에반스(Christopher H. Evans) 박사는 류마티스관절염(RA)환자에 대한 인터류킨(IL)-1수용체아고니스트(Ra) 유전자치료의 제1상 임상시험 결과 “잠재적 치료유전자를 사람관절에 집어넣어 도입 유전자를 관절속에서 발현시킬 수 있다”고 결론내렸다. 자세한 내용은 Proceedings of the National Academy of Sciences, USA (2005;102:8698-8703)에 발표됐다.
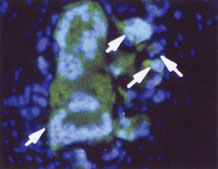
[그림설명]
활막표면에 붙어있는 고농도의 IL-1Ra(녹색)을 발현한 섬유아세포
[제공:Proceedings of the National Academy of Sciences, USA]]
자기활막 섬유아세포 주입
에반스 박사는 진행한 RA를 가진 폐경후 여성 9명의 관절에서 활막조직을 채취했다.
이들 환자는 2부터 5중수지관절(MCP)의 일측성 사일라스틱(silastic) 관절성형술이 예정돼 있었다.
환자에 대한 부신피질 스테로이드는 치험하기 1개월 전에 중지했지만 다른 약물은 계속 투여했다.
박사는 자기활막 섬유아세포의 배양계를 만들어 IL-Ra cDNA를 가진 레트로바이러스에 각 배양세포를 형질도입한 경우와 형질도입하지 않은 경우 2개군으로 나누고 각 환자의 4개 MCP관절 중 2개에 형질도입 세포를, 나머지 2군의 MCP관절에 대조세포를 주입했다.
이 실험은 용량증가와 이중맹검방식으로 실시됐으며 1주 후에 관절을 절제했다. RT-폴리머레이스연쇄반응(PCR), IL-Ra의 in vitro생산, in situ 하이브리다이제이션, 면역조직화학검사를 이용하여 유전자 도입과 발현이 성공했다는 증거를 판정했다.
박사는 “대조관절과는 달리 형질도입세포를 주입한 관절은 RT-PCR 시그널이 양성을 보였다. 중용량과 고용량을 투여한 환자의 MCP 관절로부터 채취한 활막에서는 IL-1Ra의 생산량이 증가했다(P=0.01). 형질도입한 관절활막 상에 고농도의 IL-1Ra를 발현하는 세포집단이 존재했다”고 설명한다.
흥미롭게도 가장 낮은 용량의 유전자 도입세포를 주입한 관절의 배양세포에는 도입 유전자가 없는데도 IL-1Ra의 합성은 거의 나타나지 않았다.
대조적으로 고용량의 유전자 도입세포를 주입한 관절 12례 중 11례에서는 IL-1Ra생산이 뚜렷하게 증가하는 것으로 나타났다. 한편 대조관절에서는 1례만이 RT-PCR시그널 양성을 보였다.
박사는 형질도입세포를 주입한 관절에서 채취한 조직의 in situ 하이브리다이제이션과 면역조직화학검사에 의해 활막표면에 부착하는 대량의 Il-1Ra를 발현하는 세포진답을 발견했다. 대조관절에는 이러한 세포집단은 없었다.
한편 이번 치험에서는 부작용은 관찰되지 않았으나 관절내 주입 도중 일시적인 불쾌감과 그 후의 반상출혈이 다수 보고됐다.
IL-1Ra cDNA의 관절도입은 RA 동물모델에서 질환을 줄여준다고 알려져 있었다.
또 임상연구에서 변환형 Il-1Ra가 RA환자에서 항염증작용과 항미란성작용을 가진 것으로 알려져 있다. Il-1Ra는 우수한 안전성을 갖고 있어 이 유전자가 선택됐다.
부작용 판정위해 발표 지연
이번 방법과 변환IL-Ra를 투여하는 방법을 비교하고 에반스 박사는 “유전자를 관절내에 투여하는 것은 국소에서 고농도의 IL-Ra를 지속적으로 생산할 수 있는 치료상의 장점이 있다. 또 이 IL-Ra는 변환형체와는 다르게 원래의 번역 후 프로세싱을 받는다. 또 변환 단백질을 매일 피하투여해도 다음번 주사때 까지 IL-Ra 치료적정혈청농도를 유지할 수 없다”고 설명한다.
박사는 실제로 이 실험을 수년전에 실시했지만 임상적 또는 분자적 증거에 의한 부작용 판정을 내리기 위해 무려 5년이나 발표를 늦췄다.
1주 후에 주입관절을 외과적 절제했는데도 유전자 변환세포가 이동하여 체내에 잔류할 위험이 있었기 때문이다.
박사는 “사람 관절에 유전자를 도입하는 장점은 도입 유전자의 발현이 해부학적으로 닫혀진 특정 장소인 관절 자체에 한정된다는 것”이라고 설명한다.
또 체외 유전자도입을 이용한 것은 안전성을 배려했기 때문이다. 이 기술은 피험자에게 감염성인자를 도입할 필요가 없다. 박사는 일련의 염증성질환 및 자가면역질환, 변형성관절증(OA), 일부 정형외과질환 등의 치료에 이번 사용한 것과 동일한 유전자적 방법을 응용하고 있다.
에반스 박사는 Gene Therapy (2004;11:379-389)에서 OA에 대한 유전자 치료에 대해 “관절내에 유전자를 도입하는 부위에는 활막과 연골을 고려할 수 있다.
다른 정형외과질환에도 응용
활막에 대한 유전자 도입으로 큰 실험적 발전이 얻어지고 있다. 활막은 in vivo와 in vitro 프로토콜을 이용한 각종 벡터로 인해 유전자 변형 영향을 받기 쉬운 조직이다.
지금까지는 이 유전자 산물이 연골기질의 합성을 증가시키거나 그 파괴를 억제시키는 유전자 도입에 주목되고 있지만 다른 것을 표적으로 하는 치료도 고려할 수 있다”고 설명한다.
정형외과 유전자 치료와 관련하여 박사는 Clinical Orthopaedics and Related Research (2004;429 :316-329)에 다음과 같은 논설을 발표했다.
“손상받은 근골격조직의 수복은 가장 유익한 연구분야임이 증명돼 전임상연구에서는 놀랄정도로 골절치유가 촉진되고 있다. 연골수복, 인대치유, 건과 반월판 등 각종 부속조직의 회복 등을 개선시키기 위한 유전자도입에도 급속한 발전이 있었다. 또 추간판변성, 무균성 동요관절, 골다공증, 유전성질환, 정형외과 종양 등에도 응용할 수 있다. 유전자 치료에서 각종 정형외과 영역의 표적 가운데 가장 빠른 임상효과를 얻을 수 있는 것은 조직수복이다. 이것은 기존의 기술을 응용하여 조직수복이 가장 빠른 임상적 성공을 얻을 수 있는 것 중 하나가 될 것이다. 정형외과가 사람 유전자치료를 선도하는 분야가 되는 것은 확실하다.”
골다공증 골절치유에도 응용
또 최근 에반스 박사는 Osteoporosis International (2005;16 Suppl 2:S120-S128)에서 골다공증에서의 골절에 대한 유전자 치료 가능성을 논하고 있다.
“유전자도입에 의한 치료 어프로치의 매력은 해부학적으로 정확한 위치에 정확하게 프로세싱된 유전자 산물을 지속적으로 치료 적정농도로 보낸다는 독특한 능력이다. 만성질환의 치료와는 달리 골절치유를 달성하기 위해서는 몇주간 또는 수개월 이상 도입유전자가 발현할 필요가 없으며 또 바람직스럽지도 않다.”
