제네릭 의약품에 대한 가격제도가 차등화된다.
보건복지부는 27일 제네릭의약품의 가격제도를 현재 동일제제-동일가격 원칙에서 제네릭 개발 노력 정도에 따라 달라지는 차등가격제로 변경한다고 밝혔다.
이번 개편방안은 지난해 발사르탄 사태가 계기가 됐다. 당시 발사르탄 원료 의약품에서 N-니트로소디메틸아민이라는 불순물이 검출됐다.
발사르탄의 불순물 검출 사례는 외국에서도 있었지만 판매중지 품목수는 미국과 영국이 각각 10개와 5개인데 비해 우리나라는 174개에 달했다.
주요 원인은 공동 생물학적 동등성 시험제도와 높은 제네릭 약가 수준으로 인한 제네릭의 난립 및 원료 품질관리 미비였다.
이에 따라 이번 약가제도 개편안은 제네릭 의약품에 대한 제약사의 책임성을 강화하고 개발 시간과 투자비용에 비례해 보상하는 것이다.
특히 이번 개편방안은 지난달 식품의약품안전처가 발표한 제네릭의약품 허가제도 개편 방향과 연계해 추진된다.
개편방안의 주요 내용에 따르면 의약품 성분별 일정 개수 내(20개)에서는 건강보험 등재 순서와 상관없이 2개 기준 요건 충족 여부에 따라 제네릭 의약품 가격이 산정된다.
2가지 기준은 △자체 생물학적 동등성 시험 실시 △등록된 원료의약품 사용이다. 이 요건을 갖출 경우 현재처럼 오리지널의약품의 53.55%에 해당하는 가격을 받는다.
반면 건보 등재 순서 21번째부터는 기준 요건 충족 여부와 무관하게 등재된 20개 제네릭 최저가의 85% 가격을 받는다[표].
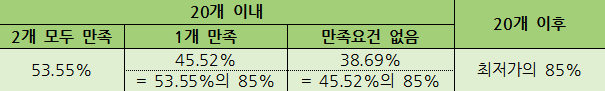
예컨대 21번째 제네릭은 20개 내 제품 최저가의 85%로, 22번째 제네릭은 21번째 제네릭 가격의 85%를 산정하는 방식이다.
이번 약가개편은 올 하반기부터 실시될 예정이다. 하지만 제약계 및 의료 현장의 혼란을 줄이기 위해 신규 제네릭과 기존 등재된 제네릭(건보급여 제네릭)으로 구분해 적용 시점을 다르게 할 계획이다.
신규 제네릭은 규정 개정 및 일정 기간 경과 후 건강보험 급여를 신청하는 제품부터 개편안을 올해 안에 실시한다.
반면 기존 등재된 제네릭은 기준 요건 적용 준비에 소요되는 기간을 고려해 3년간의 준비기간을 두고 개편안을 적용할 계획이다.
또한 기존 등재된 제네릭의 경우 20개 개수 제한은 적용되지 않고 기준 요건 충족 수준에 따른 가격 차등 방안만 적용된다.
예컨대 건보급여를 받는 A성분의 제네릭 의약품이 30개 등재돼 있는 경우 이들 의약품에는 기준 요건 충촉 여부만 적용한다는 것이다.
하지만 31번째 의약품은 기존 30개 의약품 중 최저가 또는 38.69% 중 낮은 가격의 85%로 산정한다. 이후 등재되는 의약품은 31번째 의약품 가격의 85%를 적용한다.
복지부는 이번 개편안을 통해 제약사의 제네릭 의약품에 대한 책임성 과 대내외 경쟁력 및 환자 안전관리가 강화될 것으로 기대하고 있다.
