
성균관의대 강북삼성병원 내분비내과
체중 증가는 인슐린 치료에서 가장 큰 장벽일 수 있다. 환자는 체중 증가에 대한 두려움 때문에 인슐린 투여량을 피하려 하고, 체중 증가는 당뇨병 환자에서 심혈관 위험인자에 나쁜 영향을 미칠 수 있다. 저혈당 위험이 감소된 혈당의 효율적인 조절과 체중에 대한 중립적 효과가 인슐린 디터머의 중요한 특성이다. 따라서 환자에게는 인슐린 치료가 이상적인 혈당 조절 방법임을 보여줄 수 있는 인슐린 제제라고 할 수 있겠다.
증 례
Insulin detemir의 weight benefit?
많은 연구에서 인슐린이나 경구용 혈당강하제를 이용한 혈당 조절은 원치않는 체중 증가를 동반하는 것으로 밝혀져 있다. 제2형 당뇨병 환자의 체중 증가는 fat은 물론 fat-free mass의 증가로 발생한다고 알려져 있다1,2,3. 제1, 2형 당뇨병 환자 전체에서 체중 증가는 지질 농도와 수축기혈압 등의 심혈관질환 위험인자의 악화를 초래했다4,5. 또한 인슐린 치료에 따른 체중 증가는 그 정도에 따라 염증 마커의 변화를 가져오며, 이는 동맥경화증에 대한 위험을 높일 수 있다6. 체중증가는 원래 비만한 제2형 당뇨병 환자에 특히 나쁜 영향을 줄 수 있으며 치료 순응도에도 영향을 줄 수 있다.
인슐린 디터머(detemir)는 재조합 DNA 기술로 만들어진 중성의 soluble, long-acting 인슐린 아날로그다7. B29 부위의 지방산 분자의 acylation이 인슐린 디터머가 역으로 알부민과 결합되도록 하며, 기존 인슐린 제제보다 안정적인 약물역동학적 프로필을 보인다8. 여러 임상 및 관찰연구에서 인슐린 디터머가 기존 인슐린에 비해 환자간 변이성이 적고, 저혈당 비율을 낮게 유지시키면서 혈당을 효율적으로 낮춘다고 보고됐다.
임상연구 결과에서 인슐린 디터머가 제1, 2형 당뇨병 환자에서 체중증가가 적다고 보고되고 있다9. 6건의 다국적, 다기관 3상 연구에서도 제1, 2형 당뇨병 환자에서 16~24주간 인슐린 디터머 투여시 NPH 인슐린에 비해 체중 증가가 적다고 보고됐다10. 제1형 당뇨병 환자에서 실시한 De Leeuw 등의 연구에서11, NPH 인슐린에 비해 인슐린 디터머의 체중에 대한 베네핏(benefit)은 1년까지 유지됐다 (P<0.001). 제2형 당뇨병 환자에서 인슐린 디터머를 경구 혈당강하제에 추가했을 때 1년 후 체중 증가는 인슐린 글라진에서 유의하게 적다고 보고됐다12. 마찬가지로 모든 아날로그 인슐린과의 basal-bolus 용법은 (인슐린 디터머 plus mealtime 인슐린 아스파트) 22주간 치료 효과를 비교했을 때, 기존의 휴먼 인슐린용법 (NPH 인슐린 plus mealtime RI) 체중 증가가 유의하게 적었다13.
PREDICTIVE (Predictive Results and Experience in Diabetes Through Intensification and Control to Target: An International Variability Evaluation) 연구는 대규모, 전향적, 공개적인 관찰 연구다. 그리고 인슐린 디터머를 일반적인 임상에서 투여했을 때 나타나는 효과와 안전성을 관찰한 연구이다.
PREDICTIVE 연구는 지금까지 약 20개국에서 3천명 이상의 제1, 2형 당뇨병 환자를 모집했다. 이 연구의 1차 엔드포인트는 인슐린 디터머 투여시 약물 부작용을 보는 것이었다. 2차 엔드포인트는 당화혈색소(HbA1c), 공복혈당치, 체중변화, 인슐린 투여량, 투여(titration) 스케쥴 그리고 병용투여된 당뇨약을 비교하는 것이었다.
PREDICTIVE 연구의 유럽 코호트 기초 자료를 분석한 결과를 보면, 제1, 2형 당뇨병의 체중 증가에 영향을 주는 인자는 다른 것으로 보인다14. 제1형 당뇨병 환자에서 체중 증가는 공복혈당의 변이성(variability)과 연관이 있는 것으로 보인다. 그러나 제2형에서는 당뇨병 치료제에 따라 차이가 있다고 보고됐으며 인슐린 치료 중인 환자에서는 인슐린 투여 횟수와 관련이 있었다.
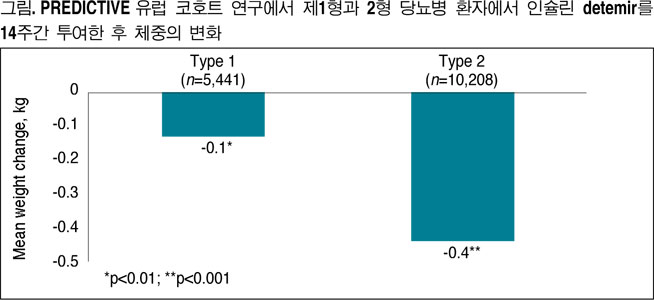
또다른 분석 결과에 따르면 제1, 2형 당뇨병 환자에서 인슐린 디터머를 14주간 투여하면 혈당 조절이 양호했고 체중 증가도 없었다(그림)15. 또한 독일인 코호트의 서브그룹 분석에서 연구 전 당뇨병 치료와 비교시 인슐린 디터머 투여 3개월 후에도 과거 어떤 치료를 받았는지에 상관없이 체중은 증가하지 않았다16.
이밖에도 인슐린 디터머가 체중에 미치는 중립적인 효과에 대해서는 여러가지 이론이 있다. 그 중 한가지는 인슐린 디터머가 알부민과 결합하는 특성이 간/말초 인슐린 gradient를 정상으로 회복시키기 때문이라는 것이다17. 즉 알부민에 결합한 인슐린 디터머는 미세혈관-내피 세포벽을 투과하지 못하게 되면서 인슐린 디터머가 전신순환에서 말초의 표적 조직으로 이동하는 속도를 낮추는 것이다. 그러나 간으로는 이런 배리어(barrier)가 없어서 알부민과의 결합 여부에 상관없이 인슐린 디터머는 간으로 투과해 들어갈 수 있다. 따라서 간세포가 더 높은 농도의 인슐린 디터머에 노출될 수 밖에 없다.
이러한 특성은 두가지 장점이 있다. 첫번째는 간에서 더 많은 알부민에 결합한 인슐린 디터머가 흡수가 될 수 있어, 지방세포나 근육에서의 작용이 줄어든다는 것이다. Hordern 등은 인슐린 디터머가 NPH 인슐린에 비해 말초 조직에서는 작용이 줄어든다는 사실을 증명했다17. 두번째는 인슐린 디터머가 간에서 당신생을 억제하는 효과가 더 크다는 것이다18. 따라서 인슐린 디터머는 체중 증가의 경향을 줄일 수 있는 생리적인 혈당 조절의 작용 기전을 갖고 있다.
인슐린 디터머와 식욕 조절에 대한 연관성도 제기되고 있다. 식욕 조절의 중심기전(central mechanism)은 매우 복잡한데 여러 연구 결과에서 인슐린의 역할이 강조되고 있다. 실험 동물연구에서 인슐린 시그널링(signaling)의 억제가 비만과 연관된 당뇨병의 발생과 관련있다고 알려져 있다19,20. 또한 다른 실험 연구에서는 인슐린이 시상하부에 작용하는 anorexic hormone으로 알려져 있다21,22. 또한 인슐린은 인간에서 체중과 체지방 정도를 조절하는데 negative feedback을 가졌다고 알려져 있다23.
최근 연구에서 쥐를 대상으로 한 연구에서는 인슐린 디터머와 RI의 간과 근육에서의 인슐린 시그널링 캐스캐이드(signaling cascade) 시간, 과정, 활성화 정도는 비슷하지만, 뇌에서는 인슐린 디터머의 작용이 더 증강된 것으로 나타났다24. 이러한 효과는 지방산 고리의 결합이 뇌척수액으로 더 활발하게 유입시켜 뇌속의 인슐린 디터머 농도를 증가시켜주기 때문으로 생각된다. 이러한 기전을 갖고 있는 인슐린 디터머가 뇌에 직접 작용하여, 식욕 조절을 통해 체중 증가를 예방한다고 생각된다. 인슐린 디터머의 안정적인 지속성도 체중에 대한 중립성에 기여하는 것으로 보인다. 인슐린 디터머는 혈당 반응을 더 안정적으로 유지시키는 약물역동학적 프로필을 갖고 있으며 다른 인슐린 제제보다 저혈당이 적다고 보고되고 있다.
이처럼 안정적인 혈당 유지는 저혈당에 따른 반응적 음식 섭취 빈도를 줄이고, 저혈당에 대한 두려움을 줄여 환자가 저혈당에 대한 예기 불안 때문에 방어적으로 간식 섭취를 함으로써 체중 증가를 막는다. 실제로 최근 NPH 인슐린 치료를 받는 제2형 당뇨병 환자에서 저혈당과 체중 증가가 통계적으로 유의한 것으로 보고됐으나 인슐린 디터머에서는 이러한 연관성이 보고된 바 없다25.
1. Salle A, Ryan M, Guilloteau G, Bouhanick B, Berrut G, Ritz P. ‘Glucose control-related’ and ‘non-glucose control-related’ effects of insulin on weight gain in newly insulin-treated type 2 diabetic patients. Br J Nutr 94:931-937, 2005
2. Salle A, Guilloteau G, Ryan M, Bouhanick B, Ritz P. Effect of insulin treatment on the body composition of type 2 diabetic patients. Diabet Med 21:1298-1303, 2004
3. Hartman I. Intensive diabetes therapy and body weight: focus on insulin detemir. Endocrinol Metab Clin North Am. 36 Suppl
4. Purnell JQ, Hokanson JE, Marcovina SM, Steffes MW, Cleary PA, Brunzell JD. Effect of excessive weight gain with intensive therapy of type 1 diabetes on lipid levels and blood pressure: results from the DCCT. Diabetes Control and Complications Trial. JAMA 280:140-146, 1998
5. Ridderstrale M, Gudbjornsdottir S, Eliasson B, Nilsson PM, Cederholm J; Steering Committee of the Swedish National Diabetes Register (NDR). Obesity and cardiovascular risk factors in type 2 diabetes: results from the Swedish National Diabetes Register. J Intern Med 259:314-322, 2006
6. Schaumberg DA, Glynn RJ, Jenkins AJ, Lyons TJ, Rifai N, Manson JE, Ridker PM, Nathan DM. Effect of intensive glycemic control on levels of markers of inflammation in type 1 diabetes mellitus in the diabetes control and complications trial. Circulation 111:2446-2453, 2005
7. Hordern SV, Russell-Jones DL. Insulin detemir, does a new century bring a better: basal insulin? Int J Clin Pract 59: 730-739, 2005
8. Kurtzhals R. Engineering predictability and protraction in a basal insulin analogue: the pharmacology of insulin detemir. Int J Obes 28 Suppl 2: S23-S28, 2004
9. Bush MA. Intensive diabetes therapy and body weight: focus on insulin detemir. Endocrinol Metab Clin North Am 36 Suppl
10. Garber AJ, Olsen KJ, Draeger E. Treatment with insulin detemir provides improved glycemic control and less weight gain compared to NPH insulin in people with diabetes, 64th Annual Scientific Sessions of the American Diabetes Association (June 4-8, 2004) Orlando, Florida. Abstract
11. DeLeeuw I, Vague P, Selam JL. Insulin detemir used in basal-bolus therapy in people with type 1 diabetes is associated with a lower risk of nocturnal hypoglycaemia and less weight gnu over 12 months in comparison to NPH insulin. Diabetes Obes Metab 7:73-82, 2005
12. Rosenstock J, Davies M, Home PD et al. Insulin detemir added to oral anti-diabetic drugs in type 2 diabetes provides glycemic control comparable to insulin glargine with less weight gain. Diabetes 55 (2006), p. A132 (Suppl), Abstract
13. Raslova K, Bogoev M, Raz I, Leth G, Gall MA, Hancu N. Insulin detemir and insulin aspart: a promising basal-bolus regimen for type 2 diabetes. Diabetes Res Clin Pract 66:193-201, 2004
14. Gydesen H, Gallwitz B, Clauson PG et al. Predictors of weight and FBG variability in insulin-tLeated patients: data flora the European Cohort of the PREDICTIVE study, 42nd Annual Meeting of the European Association for the Study of Diabetes (September 14-17, 2006) Copenhagen, Denmark. Abstract
15. Dornhorst A, Luddeke HJ, Sreenan S et al. and PREDICJTIVE Study Group. Safety and efficacy of insulin detemir in climcal practice: 14-week follow-up data from type 1 and type 2 diabetes patients in the PREDICTIVE™: European cohort. Int J Clin Pract 61:523-528, 2007
16. Meneghini LR, Rosenberg KH, Koenen C et al. Insulin detemir improves glycaemic control with less hypoglycaemia and no weight gain in patients with type 2 diabetes who were insulin naive or treated with NPII or insulin glargine: clinical practice experience from a German subgroup of the PREDICTIVE study. Diabetes Obes Metab 9:418-427, 2007
17. Hordern SV, Wright JE, Umpleby AM et al. Comparison of the effects on glucose and lipid metabolism of equipotent doses of insulin detemir and NPH insulin with a 16-h euglycaemic clamp. Diabetologia 48:420-426, 2005
18. Plank J, Bodenlenz M, Sinner E et al. A double-blind, randomized, dose-response study investigating the pharmacodynamic and pharmacokinetic properties of the long-acting insulin analog detemir, Diabetes Care 28:1107-1112, 2005
19. Lin X, Taguchi A, Park S et al. Dysregulation of insulin receptor substrate 2 in beta cells and brain causes obesity and diabetes, J Clin Invest 114:908-916, 2004
20. Porte D Jr, Baskin DG, Schwartz MW. Insulin signaling in the central nervous system: a critical role in metabolic homeostasis and disease from C elegaels to humans. Diabetes 54:1264-1276, 2005
21. Patel BK, Koenig JI, Kaplan LM, Hooi SC. Increase in plasma Leptin and Lep mRNA concentrations by food intake is dependent on insulin. Metabolism 47: 603-607, 1998
22. McGowan MK, Andrews KM, Kelly J, Grossman SR. Effects of chronic intrahypothalamic infusion of insulin on food intake and diurnal meal patterning in the rat. Behav Neurosci 104: 373-385, 1990
23. Benedict C, Hallschmid M, Hatke A et al. Intranasal insulin improves memory in humans, Psychoneuroendocrinology 29:1326-1334, 2004
24. Hendige AM, Sartorius T, Tschritter O et al. Tissue selectivity of insulin detemir action in vivo. Diabetologia 49: 1274-1282, 2006
25. Derezinski T, Davies M, Kim H, Clauson R. No correlation between weight gain and number of hypoglycemic events in patients with type 2 diabetes treated with instflin detemir as compared to NPH insulin, 42nd Annual Meeting of the European Association for the Study of Diabetes (September 14-17, 2006) Copenhagen, Denmark. Abstract
